Ein führendes Pharmaunternehmen benötigte Unterstützung bei der Vorbereitung und Einreichung eines Antrags auf Arzneimittelzulassung (New Drug Application, NDA) für eine neue Krebstherapie. Dem Unternehmen war klar, dass sich der Zulassungsprozess nur durch eine mängelfreie Zulassungseinreichung beschleunigen ließ.
Das Unternehmen musste eine Vielzahl komplexer klinischer und nicht-klinischer Daten in einem Einreichungsdossier zusammenstellen und formatieren. Außerdem mussten dabei die strengen FDA- und EMA-Anforderungen eingehalten werden.
Das Unternehmen wandte sich an Willingjet als Partner für maßgeschneiderte Zulassungsservices. In enger Zusammenarbeit mit uns wurde ein strategischer Einreichungsplan ausgearbeitet, bei dem unsere Erfahrung im Bereich Onkologie und Zulassungen zum Tragen kam.
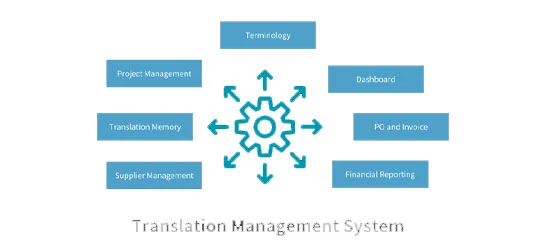
Die wichtigsten Schritte im Überblick
Umfassendes Dokumentenmanagement: Unser Team stellte sorgfältig alle erforderlichen Dokumente zusammen, die Daten zu klinischen Versuchen, nicht-klinischen Studien und CMC-Informationen beinhalteten, und bereitete ein strukturiertes, formatiertes Zulassungsdossier vor.
Entwicklung einer Compliance-Strategie: Wir arbeiteten eng mit dem Kunden zusammen an einer robusten Compliance-Strategie, identifizierten potenzielle Herausforderungen und optimierten den Zulassungszeitplan auf effiziente Weise.
Management globaler Einreichungen: Beim Vorbereiten und Managen von Zulassungseinreichungen bei internationalen Zulassungsbehörden wie der FDA und EMA konnten wir auf unsere Erfahrung mit globalen Einreichungen zurückgreifen und so die Compliance mit regionalen Anforderungen gewährleisten.
Qualitätssicherung und Fehlerkorrektur: In jeder Projektphase wurden Qualitätsprüfungen durchgeführt, um etwaige Fehler aufzudecken und zu beheben. Außerdem unterstützten wir den Kunden beim Beantworten von Fragen der Zulassungsbehörden.
Schnellere Zulassung: Aufgrund der optimierten Zulassungsservices verlief der Zulassungsprozess für den Kunden reibungslos, sodass er seine innovative Krebstherapie schneller in Verkehr bringen konnte.
Compliance-Gewährleistung: Unser weit gefasster Compliance-Ansatz stellte sicher, dass die Einreichungen alle regulatorischen Standards und Anforderungen erfüllten. Damit reduzierten wir das Risiko einer Ablehnung oder Verzögerung.
Strategische Partnerschaft: Durch strategische Partnerschaft mit Willingjet profitierte der Kunde von der Beratung durch unsere ExpertInnen, individuellem Support und unserem erprobten Ansatz für erfolgreiche Zulassungen.
Die Zusammenarbeit mit Willingjet verhalf dem pharmazeutischen Unternehmen dazu, die Zulassung der Krebstherapie zu beschleunigen. Unsere Services und Fachkenntnisse strafften den Zulassungsprozess, stellten die Compliance sicher und sorgten damit dafür, dass lebensrettende Behandlungen schneller für PatientInnen verfügbar waren.

 EN
EN  cn
cn  de
de  jp
jp 




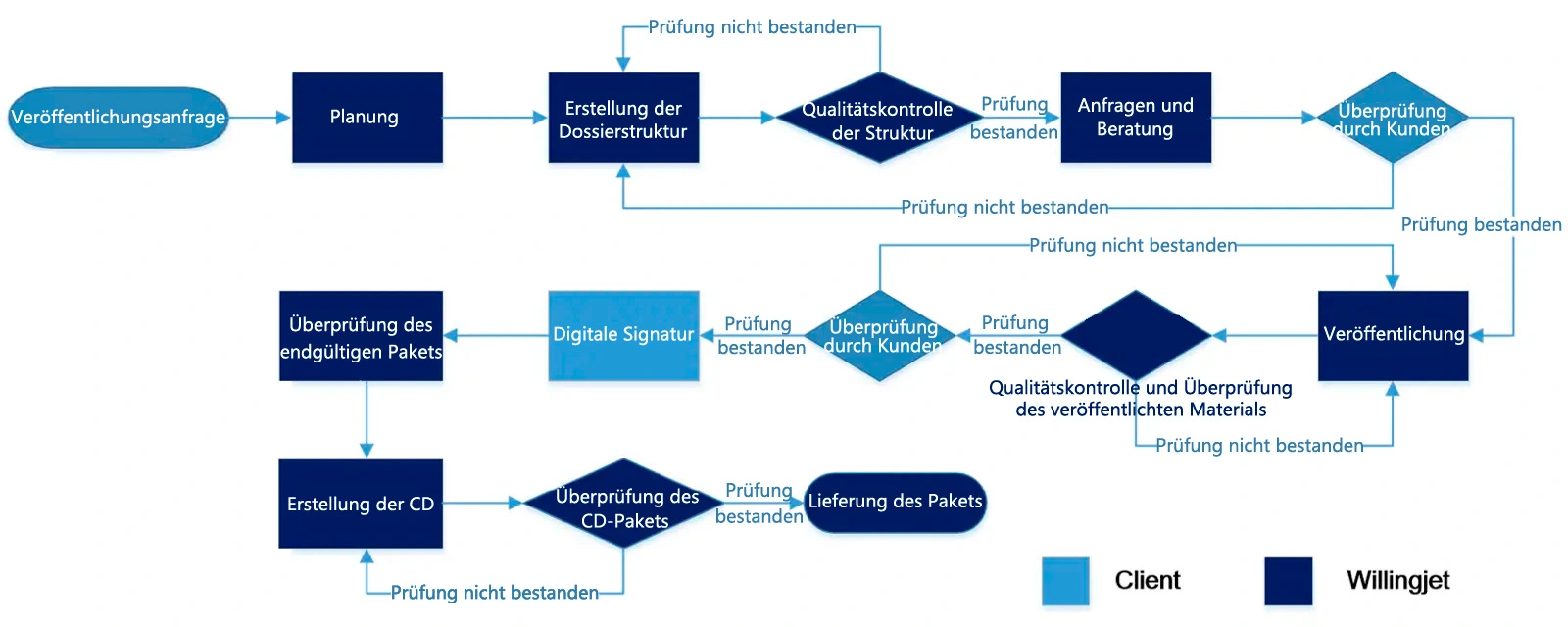
 Was genau beinhaltet der Zulassungsprozess?
Was genau beinhaltet der Zulassungsprozess?